糖尿病・加齢 臨床研究グループ(目黒 周)
研究テーマ
- 機械学習を用いた2型糖尿病における腎不全の予測モデルの作成(渡辺麻里先生、旭化成との共同研究)
- 川崎市の85歳以上の高齢者コホートにおける食事内容と予後(倉田英明、百寿総合研究センター 新井康通教授との共同研究)
- GDMにおけるオンライン診療システムの有効性、安全性(青山和樹先生、中島裕也先生)
研究内容概説
医学において実証されている事はとても少なく、定説とされていることが簡単に覆されることにいつも驚かされます。私が医師になった1990年代以降からだけでも、胃潰瘍・胃がんの原因としてのピロリ菌、抗不整脈薬の催不整脈作用、心不全に対するβブロッカー、SGLT2阻害薬の評価など枚挙にいとまがありません。これはひとえに私たちが見ている生命現象の複雑さを背景にしてものであり、多くの場合「理論」から演繹されるよりも、日々の診療や研究の中での注意深い「観察」から帰納されることが多いように思われます。私たちは日々の診療の中で生まれる疑問を基に臨床上有用な新たな仮説を生み出し実証したいと考えています。
私たちの研究テーマは糖尿病の慢性合併症の予測や、新しい機器システムを用いた診療システムの刷新を通して、ハイリスクの糖尿病患者さんを同定し、より負担の少ない治療の実現を目指しています。

代表的な研究論文
- Aoyama K, Nakajima Y, Meguro S, Sato Y, Goto R, Hida M, Arimitsu T, Kasuga Y, Tanaka M, Itoh H. Efficacy and safety of a telemedicine system in subjects with gestational diabetes mellitus (TELEGLAM): Study protocol for a randomized controlled trial. Heliyon. 2023 Nov 18;9(11):e22504.
- Kurata H, Meguro S, Abe Y, Sasaki T, Asakura K, Arai Y, Itoh H. Dietary protein intake and all-cause mortality: results from The Kawasaki Aging and Wellbeing Project. BMC Geriatr. 2023 Aug 9;23(1):479.
- Meguro S, Inaishi J, Sato Y, Komuro I, Itoh H. One-year estimated glomerular filtration rate decline as a risk factor of cardiovascular and renal end-points in high-risk Japanese patients. J Diabetes Investig. 2021 Jul;12(7):1212-1219.
伊藤新研究室
研究テーマ
- GLP-1受容体シグナリングによる自己免疫調節による1型糖尿病の根治療法の開発
研究内容概説
自己免疫による膵β細胞破壊によりインスリンの絶対的欠乏により発症する1型糖尿病には現在根治させる治療方法はありません。発症した患者は終生インスリン補充が必須であり、血管合併症を予防するため、日常生活を送りながら細やかな血糖管理を強いられます。
我々は根治のためには自己免疫の制御だけでなく、破壊され減少したβ細胞の維持や機能回復と血糖上昇作用のあるホルモン制御が重要であるとの考えのもと、条件に合う治療方法としてGLP-1受容体シグナリングに注目し研究を行っています。
既に免疫細胞にGLP-1 受容体が発現しておりGLP-1受容体を介して免疫細胞の機能が変化することを脂肪肝モデルを使用して報告しています。
自然発症自己免疫性1型糖尿病モデルマウスである非肥満糖尿病マウス(NODマウス)を用いて、GLP-1受容体シグナリングに介入することで糖尿病を発症したマウスを根治させその機序を解明するため研究を進めています。
本研究の結果は、まだ見ぬ1型糖尿病の根治を達成し生涯にわたるインスリン補充療法を回避できる未来の実現が期待できると考えられます。
代表的な研究論文
- Itoh A, Adams D, Huang W, Wu Y, Kachapati K, Bednar KJ, Leung PSC, Zhang W, Flavell RA, Gershwin ME, Ridgway WM. Enoxacin Up-Regulates MicroRNA Biogenesis and Down-Regulates Cytotoxic CD8 T-Cell Function in Autoimmune Cholangitis. Hepatology. 2021 Aug;74(2):835-846. doi: 10.1002/hep.31724. Epub 2021 Aug 10. PMID: 33462854.
- Itoh A, Ortiz L, Kachapati K, Wu Y, Adams D, Bednar K, Mukherjee S, Chougnet C, Mittler RS, Chen YG, Dolan L, Ridgway WM. Soluble CD137 Ameliorates Acute Type 1 Diabetes by Inducing T Cell Anergy. Front Immunol. 2019 Nov 7;10:2566. doi: 10.3389/fimmu.2019.02566. PMID: 31787971; PMCID: PMC6853870.
- Itoh A, Irie J, Tagawa H, Kusumoto Y, Kato M, Kobayashi N, Tanaka K, Kikuchi R, Fujita M, Nakajima Y, Wu Y, Yamada S, Kawai T, Ridgway WM, Itoh H. GLP-1 receptor agonist, liraglutide, ameliorates hepatosteatosis induced by anti-CD3 antibody in female mice. J Diabetes Complications. 2017 Sep;31(9):1370-1375. doi: 10.1016/j.jdiacomp.2017.05.013. Epub 2017 Jun 1. PMID: 28684145.
川野研究室
研究テーマ
- High Sugarに伴う腸管免疫の恒常性破綻メカニズムの解明
- 外来・入院における糖尿病寛解プログラムの開発
- Sugar Responsive Immunocyteに着目した糖尿病管理に有効な新規バイオマーカー開発
研究内容概説
糖尿病の治療薬は昨今、飛躍的に進化を遂げています。一方で糖尿病の発症予防や寛解(薬なしでHbA1c6.5%未満を維持)させるという点においては課題が残っています。私達はこれまでに、High Sugarの摂取が腸管免疫機能を脆弱化させ、高脂肪食に伴う肥満糖尿病の悪化につながる事を発見し(Kawano Y. Cell. 2022)、糖尿病の予防や寛解の鍵として「High Sugar」と「腸管免疫」に着目しています。High Sugar摂取に伴い、腸管や皮膚、脳等の全身臓器にどの様な免疫学的変化が起き、それが肥満や糖尿病の発症において病態生理学的にどんな意味を持つのかを解明していきます。また、High Sugar応答性の免疫学的事象に着目する事で、患者への治療フィードバックに有用な新規のバイオマーカーの同定を試みます。最終的には基礎研究と臨床研究を統合し、糖尿病を寛解させるための外来・入院治療プログラムを提案しようと考えて、研究活動を行っています。

代表的な研究論文
- Kawano Y, Edwards M, Huang Y. et al. A. Microbiota imbalance induced by dietary sugar disrupts immune-mediated protection from metabolic syndrome. Cell. 2022
- Kawano Y, Nakae J, Watanabe N. et al. Colonic Pro-inflammatory Macrophages Cause Insulin Resistance in an Intestinal Ccl2/Ccr2-dependent Manner. Cell Metabolism, 2016
- Kawano Y, Nakae J, Watanabe N. et al. Loss of PDK1-Foxo1 Signaling in Myeloid Cells Predisposes to Adipose Tissue Inflammation and Insulin Resistance. Diabetes. 2012
予防医療研究グループ(清水 良子)
研究内容概説
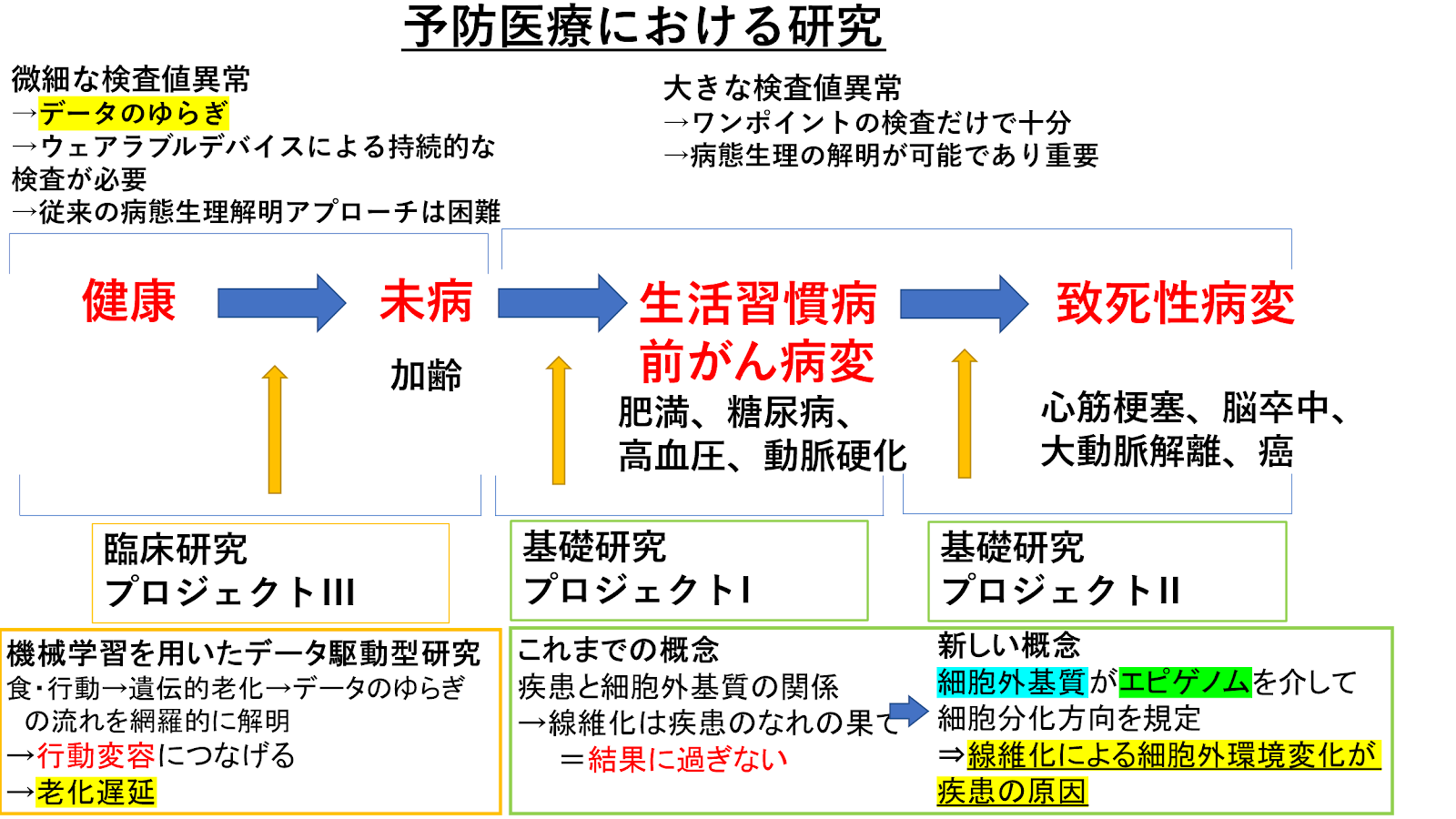
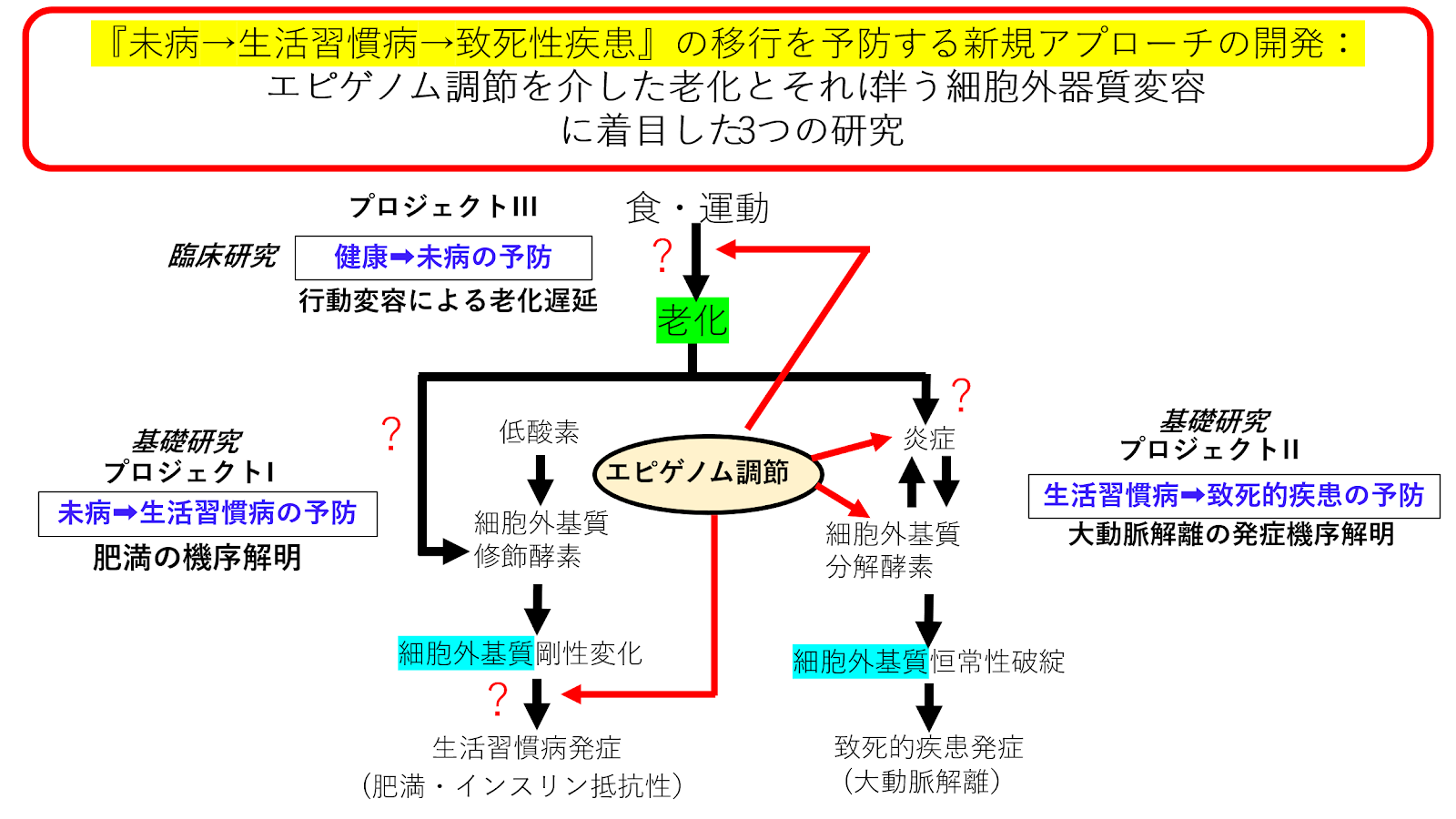
予防医療において、健康→未病→生活習慣病/前がん病変→致死性病変の各ステージの移行を予防する新規アプローチを開発することが求められています。
未病→生活習慣病→致死性病変のステージ移行においては、検査値異常が顕在化し病態生理解明がしやすいことから、私達は、この全ステージの共通項として組織リモデリング、つまり細胞外器質変容に着目して、線維化は疾患のなれの果てであり結果に過ぎないという従来の概念から、細胞外器質自体がエピゲノムを介して細胞分化能を規定し組織機能を決定している、つまり線維化による細胞外環境変化が疾患の原因である、という新しい概念のもと細胞やマウスを使って基礎研究を行っています。未病→生活習慣病移行として肥満の機序解明を、また生活習慣病→致死性疾患移行として大動脈解離の発症機序解明を研究しています。
一方、健康→未病のステージ移行では、検査値異常は微細でデータのゆらぎが見られ、従来の病態生理解明アプローチは困難であることから、私達はウェアラブルデバイスを活用した持続的な検査値取得解析が必要と考え、機械学習を活用したデータ駆動型臨床研究を行っています。食・行動から遺伝的老化が引き起こされ、それがデータのゆらぎとして表出する流れを網羅的に解析することで、行動変容につなげられる新たなアプローチを開発し、老化遅延を目指しています。
代表的な研究論文
- Neutrophil-derived matrix metalloproteinase 9 triggers acute aortic dissection.Kurihara T, Shimizu-Hirota R, Shimoda M, Adachi T, Shimizu H, Weiss SJ, Itoh H, Hori S, Aikawa N, Okada Y. Circulation. 2012 Dec 18;126(25):3070-80. (corresponding author)
- MT1-MMP regulates the PI3Kδ·Mi-2/NuRD-dependent control of macrophage immune function. Shimizu-Hirota R, Xiong W, Baxter BT, Kunkel SL, Maillard I, Chen XW, Sabeh F, Liu R, Li XY, Weiss SJ. Genes Dev. 2012 Feb 15;26(4):395-413. (1st author)
- Unbiased, comprehensive analysis of Japanese health checkup data reveals a protective effect of light to moderate alcohol consumption on lung function. Makino K, Shimizu-Hirota R, Goda N, Hashimoto M, Kawada I, Kashiwagi K, Hirota Y, Itoh H, Jinzaki M, Iwao Y, Koh M, Koh S, Takaishi H. Scientific reports 2021 Aug; 11(1) :15954. (corresponding author)
予防医療センターグループ(稲石)
研究テーマ
- 健診画像を用いて評価した膵形態的特徴と糖代謝指標の経時的変化に関する検討
研究内容概説
当院での剖検症例や外科手術での膵摘出標本を用いた検討も含めた膵組織学的な研究により2型糖尿病患者においてもβ細胞量が減少していることが明らかとなり、β細胞障害は1型、2型糖尿病に共通した病態であると考えられるようになってきました。今回我々は、予防医療センター健診時画像を用いて膵容量や膵脂肪を解析し、β細胞機能を含む糖代謝指標とあわせて評価することで、体重増加や耐糖能悪化による経時的な膵形態的特徴および機能的変化に関して検討を行います。2型糖尿病と膵形態的特徴・β細胞機能という観点から、その病態を解明し、個々の縦断的な変化を2型糖尿病発症予測モデルに加えることで、発症予防・治療戦略に結び付けたいと考えています。
代表的な研究論文
- Sunouchi M, Inaishi J et al. Longitudinal changes in pancreatic volume and pancreatic fat with weight gain in Japanese without diabetes: An analysis using health check-up data. Metabol open 19:100250, 2023
- Inaishi J, Saisho Y et al. Association of glucose tolerance status with pancreatic β- and α-cell mass in community-based autopsy samples of Japanese individuals: The Hisayama Study. J Diabetes Investig 11(5):1197-1206, 2020
- Inaishi J, Saisho Y et al. Effects of Obesity and Diabetes on α- and β-Cell Mass in Surgically Resected Human Pancreas. The Journal of Clinical Endocrinology and Metabolism 101(7): 2874-2882, 2016